乙肝杨梅制药更新,AB-729取得积极进展,AB-161完成1期首例给药
- 2023-05-05 09:29:28
- 药品
2023年5月以来,加拿大杨梅生物制药公司(Arbutus Biopharma)对新药研发管道进行了更新,包括已在法国巴黎举行2023年全球肝炎峰会上(GHS-2023)口头报告中强调了AB-729(一种在研HBV RNAi疗法)非治疗数据以及AB-161(一种在研RNA去稳定剂)第1期临床开发首例受试者完成给药。

乙肝杨梅制药更新,AB-729取得积极进展,AB-161完成1期首例给药
AB-729最新临床开发进展(多项2a期试验中)
这7名剩余的患者在停止所有治疗后继续保持较低HBVDNA水平,乙肝表面抗原(HBsAg)水平在最后一剂AB-729治疗后的1.5年内仍然低于基线(-0.8至-1.6 log10)。
在今年4月份的全球肝炎峰会上,Arbutus公司口头报告了一项1b期临床试验(AB-729-001研究)中,已经停用AB-729和核苷(酸)类似物(NA)受试者的额外非治疗数据。
目前,Arbutus公司正在继续评估AB-729与正在进行的NA疗法和短疗程PEG-IFNα-2a(IFN)组合疗法应用于43名慢性乙型肝炎病毒感染患者(cHBV)的安全性和耐受性,该研究是一项2a期临床试验(AB-729-201研究)。该试验前期阶段初步数据进一步验证了AB-729在调降HBsAg的能力。Arbutus公司预计,将在2023年第二季度公布AB-729+NA+IFN组合疗法的初步数据。
同时还正在进行评估AB-729+NA疗法+Vaccitech公司研发的VTP-300(一种HBV抗原特异性免疫疗法)的2a期临床试验(AB-729-202研究)。Arbutus公司介绍,一旦该试验的初始部分完成招募,将开始在该试验的另一个部分招募20名受试者。
这些受试者将接受AB-729(每8周60毫克)+NA治疗24周,然后接受VTP-300加1至2个低剂量的nivolumab(Opdivo®)。Arbutus公司预计,将在2023年下半年获得AB-729+NA+VTP-300的初步数据,预计在2023年第二季度为接受AB-729、NA、VTP-300和nivolumab的额外试验组的首位受试者开始用药。

AB-161最新临床开发进展(刚进入1期)
今年3月,Arbutus公司已经对AB-161第1期临床试验开始首例在健康受试者给药,预计将在今年下半年获得单次递增剂量数据。AB-161是Arbutus公司研发的下一代口服HBV特异性RNA去稳定剂,开发作为功能性治愈HBV的潜在全口服方案一部分。
已于今年全球肝炎峰会上,Arbutus公司展示了AB-161的临床前数据,显示AB-161具有强大抗HBV活性,包括在体外和体内抑制HBVRNA和HBsAg产生。
与其他类别HBV抑制剂相比,AB-161的抗HBV作用模式有所区别,这表明AB-161有可能是功能性治愈cHBV的一个重要组成部分。
AB-101(新药临床试验申请被FDA搁置)
今年4月,Arbutus公司已收到FDA口头通知,AB-101的IND申请被搁置在临床上。Arbutus公司介绍,为明确起见,101的第1期临床试验尚未启动,也未向任何一位受试者使用AB-101。Arbutus公司不打算在今年下半年报告AB-101第1期临床试验的单剂量部分初始数据。
AB-101是一种口服PD-L1抑制剂,以唤醒和提高cHBV患者免疫系统。迄今为止产生的临床前数据表明,AB-101具有很强效力,能够介导cHBV患者的HBV特异性T细胞的激活和重振。
来自Arbutus公司总裁兼首席执行官William Collier点评2023年第一季度乙肝新药研发进展:在2023年全球肝炎峰会上,我们报告了管道内乙肝在研新药RNAi疗法AB-729数据,显示大多数患者在最后一剂AB-729后至少1.5年,他们的乙肝表面抗原和HBVDNA继续维持低水平。此外,在1期临床试验中对首位健康受试者注射了AB-161,这是Arbutus公司研发的口服RNA去稳定剂,预计今年下半年会有数据。
来自Arbutus公司乙肝新药研发管道
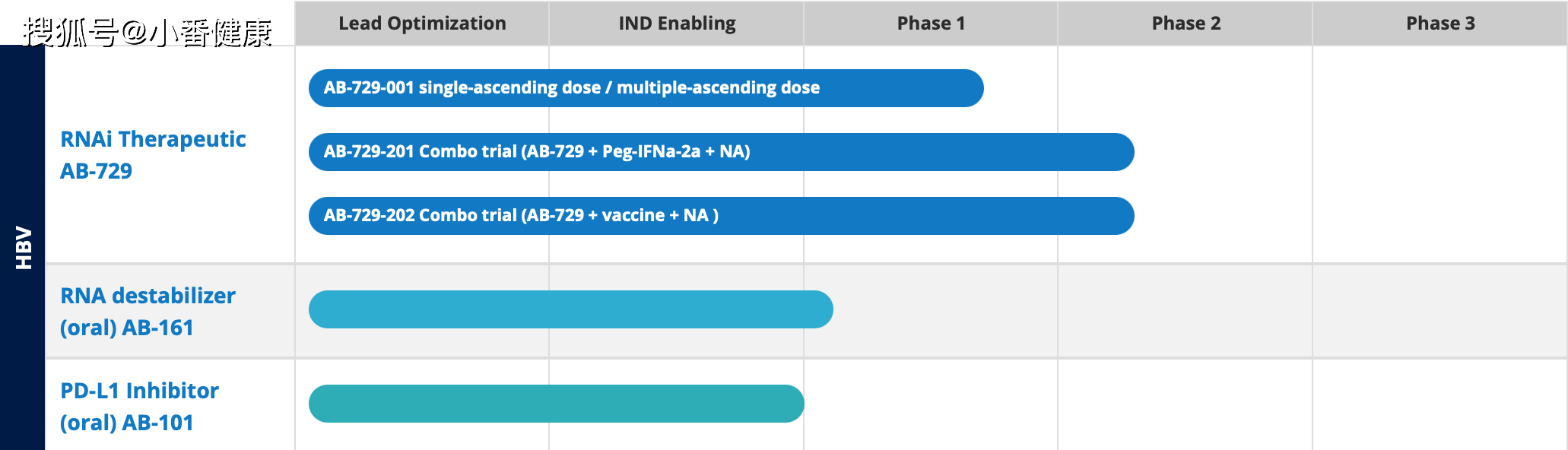
小番健康结语:Arbutus公司对HBV新药研发管道更新核心内容可以归纳为:AB-729正在多个2期临床开发中,包括AB-729-001研究和002研究,这些研究数据也将在今年不同时间发布。在今年全球肝炎峰会上报告了停用AB-729之后的一年半,有7名的乙肝表面抗原和HBVDNA水平继续维持低水平。
管道内开发为口服剂型的RNA去稳定剂AB-161,其第1期临床试验首例健康受试者已经完成用药,该1期试验初步数据预计将在今年下半年发布。开发为口服剂型的PD-L1抑制剂AB-101收到FDA通知,其IND申请已被搁置。

本文地址:http://www.bx9y.com/hangye/yaopin/2023-05-05/674144.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 乙肝杨梅制药更新,AB-729取得积极进展,AB-161完成1期首例给药2023-05-05 09:29:28
- 美国极右翼组织“骄傲男孩”四名成员被判煽动阴谋等多项重罪2023-05-05 09:00:14
- 失业保险金过了15号还没发是为什么?发放方式什么?2023-05-05 08:57:35
- 养老保险金怎样计算?可以取出来吗?2023-05-05 08:57:18
- 失业后个人缴纳社保怎么办理?一个月要交多少钱?2023-05-05 08:57:01
-

 灵活就业人员社保缴费怎么交?2022年灵活就业人员社保缴费多少钱?
灵活就业人员社保缴费怎么交?2022年灵活就业人员社保缴费多少钱?
2022-06-13
-

 2022年五险一金缴费标准最低是多少?五险一金一个月大概交多少钱?
2022年五险一金缴费标准最低是多少?五险一金一个月大概交多少钱?
2022-08-11
-
15个信号暗示你怀孕了
2022-07-04 12:49:27
-
五险一金多少钱?五险一金缴费标准是多少?
2022-07-01 16:03:05
-
2022年社保缴费基数六个档次是什么?每个月扣多少钱
2022-06-30 15:21:11
-
社保个人缴纳多少钱一个月2022?2022年社保个人缴纳比例是多少?
2022-06-23 09:37:45
-
2022年延迟退休新消息 我国延迟退休年龄对照表
2022-06-23 14:22:08
文章排行榜
- 周排名
- 月排名
- 1“五一”出行流感不容忽视! “知感冒•防流感”全民科普公益行走进江西省
- 2辽宁一大学生用5.12地震攻击成都球迷,校方:记过处分
- 3挑战与突破 ——中国医疗队在瓦努阿图推广腹腔镜技术
- 4大熊猫乐乐死因报告,究竟是怎么一回事?
- 5丫丫回国为何关注度这么高,究竟是怎么一回事?
- 6宜春市人民医院:“三高工作法”开展一季度党建工作督查
- 7热烈祝贺宜春市人民医院成为省内首批、全市唯一一家“中国前列腺癌全程化诊疗建设中心”授牌单位
- 8网传淄博派“175美少女”电驴接送游客?潮新闻核实:非官方行为
- 9重庆大巴侧翻致20伤:7人伤势较重
- 102023年养老金19连涨最新消息!2023年养老金调整方案最新消息即将公布

