5+肺腺癌预后突变特征的鉴定及免疫治疗预测~
- 2023-05-05 11:37:37
- 知识
作者:作图丫
导语
目前没有可靠的基因组标记来预测早期肺腺癌(LUAD)患者的预后。已知克隆异质性与肿瘤进展和预后预测密切相关。
背景介绍
今天小编为大家带来的这篇文章,作者开发了基于克隆多样性的预后特征(57-MPS),并且发现高危样本显示潜在的免疫抑制机制,57-MPS还提高了PD-L1对免疫治疗的预测性能。文献发表在《Journal of Molecular Medicine》上,影响因子为:5.606,文章题目为:Identification of mutational signature for lung adenocarcinoma prognosis and immunotherapy prediction。

数据介绍
本研究从TCGA, cBioPortal和相关文献收集了三个公开的LUAD组织突变数据集。
技术路线
本研究技术路线如图所示。
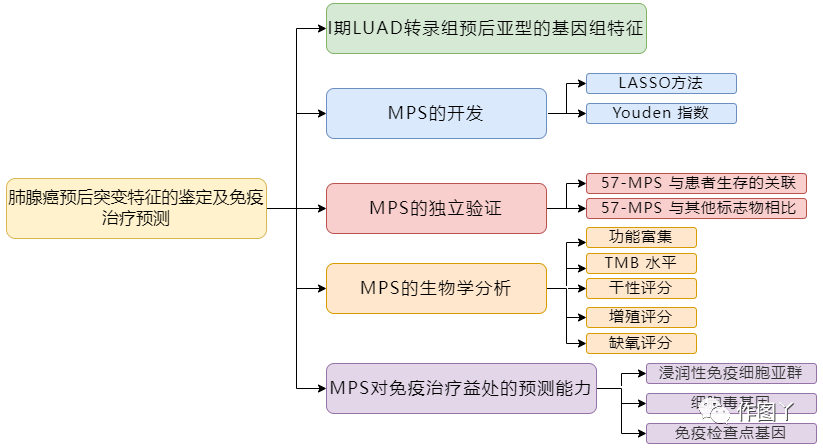
结果解析
01、I期LUAD转录组预后亚型的基因组特征
首先,本研究对TCGA数据集中处于I期的197份LUAD样本应用了稳健的转录组预后特征(40-GPS),并将103份和94份样本分别分层为预后不良和预后良好的亚型。然后,本研究探讨了属于两种转录组预后亚型的LUAD样本基因组改变的差异。通过MAF将个体的非沉默体细胞突变位点分为亚克隆或克隆,结果总共获得了36896个克隆突变位点和20296个亚克隆突变位点,这些突变在两种影响预后的转录组亚型之间的分布情况如图1a所示。结果显示,预后不良亚型克隆和亚克隆突变位点的中位数分别为88.00和197.00,均高于预后良好亚型的30.50和83.50(图1b)。此外,与预后良好亚型相比,预后不良亚型的亚克隆比例更高(图1c),表明亚克隆突变在肿瘤进展中发挥重要作用。本研究进一步计算了这些样本的TMB,发现预后不良亚型的TMB水平高于预后良好亚型(图1d)。
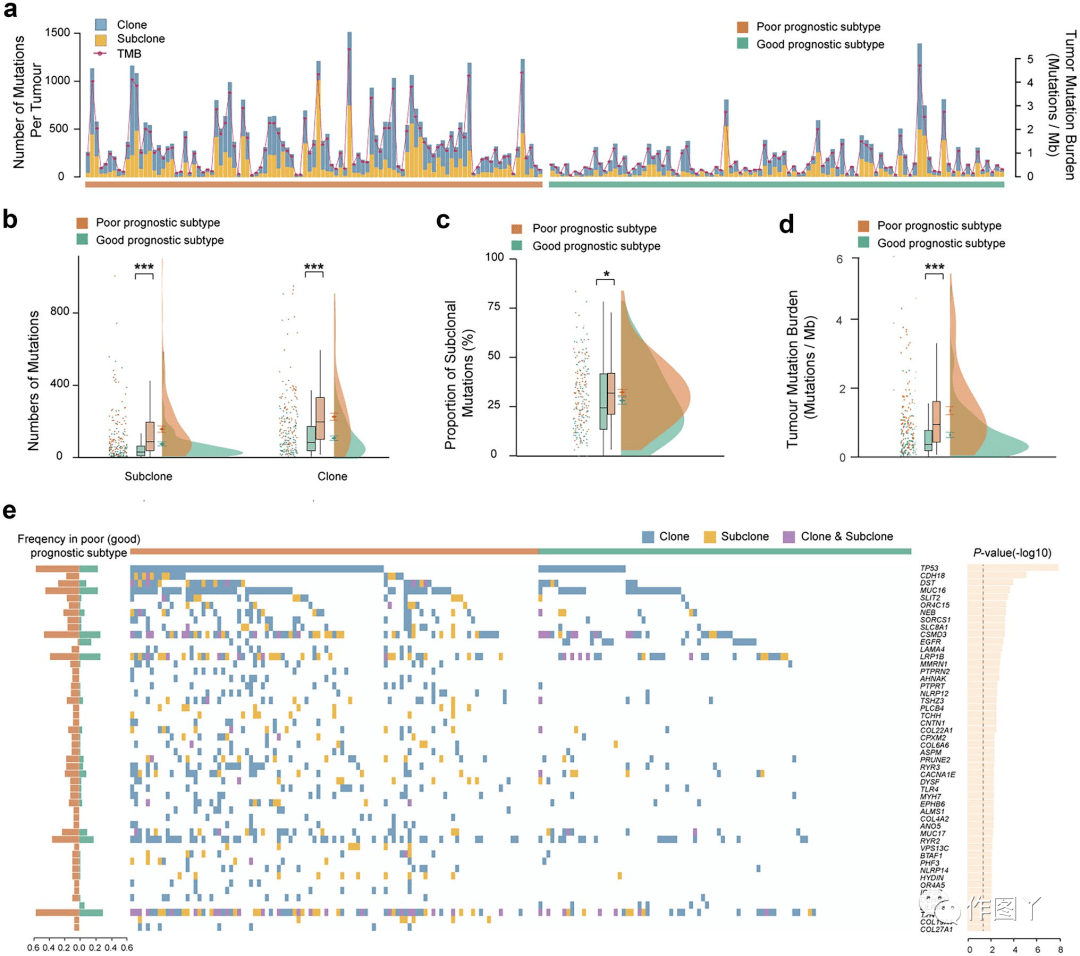
图 1
接下来,本研究在基因水平上构建了克隆和亚克隆突变矩阵,并将这两种突变组合成一个完整的突变矩阵。对于每个基因,本研究对其克隆、亚克隆和综合突变模式进行了逻辑分析和逐步回归分析,以提取与转录组预后亚型相关的特定突变模式。共有253个候选突变基因,其突变模式显示与转录组预后亚型相关 (P<0.05;图1e),由146个克隆突变基因,54个亚克隆突变基因和53个亚克隆和/或克隆突变基因组成。
02、MPS的开发
MPS的开发如图2所示,在TCGA数据集中,与转录组预后亚型相关的253个突变基因被认为是MPS发展的候选基因。本研究比较了6种特征选择(机器学习)方法在10个内部验证集中的平均AUC值(图2a),选择平均AUC值最高的LASSO方法作为开发签名的最佳方法,平均AUC值为0.863。最后,使用LASSO,本研究获得了一个由57个基因组成的最优MPS (57-MPS),用于预测整个197个样本的转录组预后亚型(AUC=0.978,图2b) 。根据 Youden 指数,风险分类的 57-MPS 的最佳截止值为 0.974(图 2b),RS 超过 0.974 的样本被预测为高风险,反之则为低风险(图 2c),并且相应的灵敏度、特异性和准确性分别为 0.922、0.989 和 0.954(图 2b)。
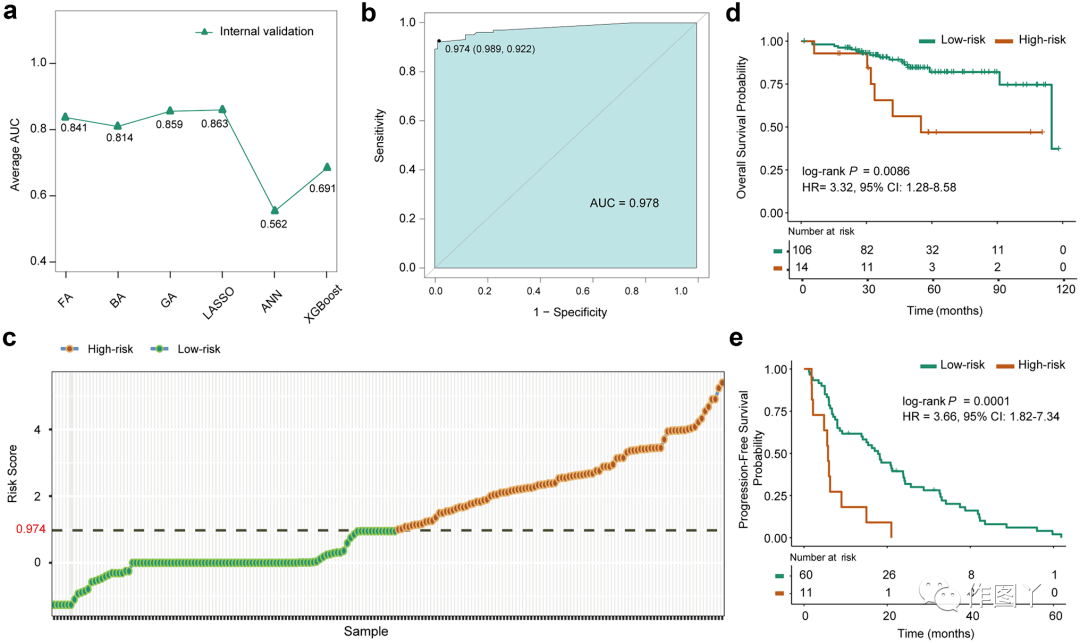
图 2
03、MPS的独立验证
本研究在两个独立的数据集中验证了 57-MPS 与患者生存的关联。测试1中,57-MPS预测的14例高危患者5年生存率为46.90%,远低于106例低危患者的82.06%,OS差异显著(图 2d)。在测试 2 中,预测高风险组的所有患者在 21 个月时疾病进展,而 41.00% 的预测低风险患者仍未进展,PFS 差异显著(图 2e)。
04、MPS的生物学分析
本研究在 TCGA 数据集中研究了通过 57-MPS 分层的高风险和低风险样本之间的临床特征和分子景观,如图 3a 所示。正如预期的那样,使用 Brunner Munzel 检验,与低风险样本相比,高风险样本具有更高的 TMB 水平(图 3b),增殖评分(图 3c),干性评分(图 3d)和缺氧评分(图 3e) 。对于其他临床特征(包括年龄、性别、分期和病理亚型),虽然没有观察到高危组和低危组之间差异的证据(Fisher 精确检验,P>0.05),但仍需要进一步探索。接下来,本研究在 57-MPS 分层的高危和低危组之间鉴定了 7892 个差异表达基因(DEG),并发现这些 DEG 在几个与肿瘤进展相关的生物过程中富集。前 80 个最重要的生物过程术语和 57-MPS 中富含这些术语的 5 个突变基因如图 3f 所示。
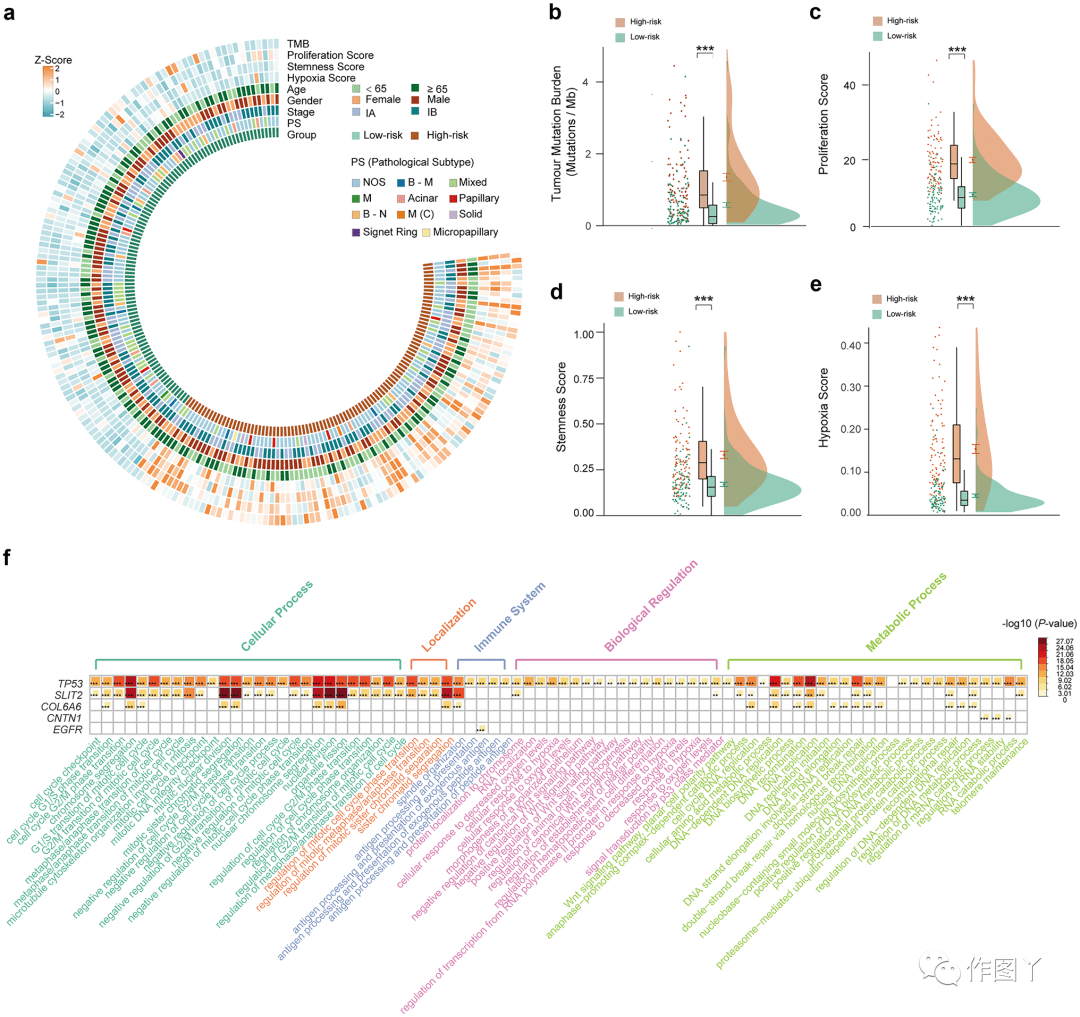
图 3
05、MPS对免疫治疗益处的预测能力
本研究观察到,按 57-MPS 分层的两个风险组之间的 DEGs 在几个免疫相关过程中显著富集,并参与抗原加工和呈递(图 3f)。与低风险组相比,这些通路中涉及的大多数 DEGs 在高风险组中被上调,表明高风险样本中的肿瘤可能具有更高水平的抗原识别和免疫激活。因此,本研究估计了 TCGA 样本中 22 个浸润性免疫细胞亚群的相对丰度水平。结果发现,与低风险组相比,一些执行或促进肿瘤杀伤功能的免疫细胞在高风险组中以异常高的水平存在(图 4a ) , 如 CD8+T 细胞和记忆激活的 CD4+T 细胞。此外,与低风险组相比,高风险组中 M2 巨噬细胞的水平相对较低(图 4a )。
本研究进一步分析了9个细胞毒基因(CD8A、CXCL10、CXCL9、GZMA、GZMB、IFNG、PRF1、TBX2和TNF)和6个免疫抑制剂/检查点基因(PD-L1、CTLA4、HAVCR2、IDO1、LAG3和PD-1)的表达水平。与低风险患者相比,高危组有6个细胞毒性基因和4个免疫检查点基因上调(图4b-c),本研究推测这些高危患者从免疫检查点抑制剂中获益更多。
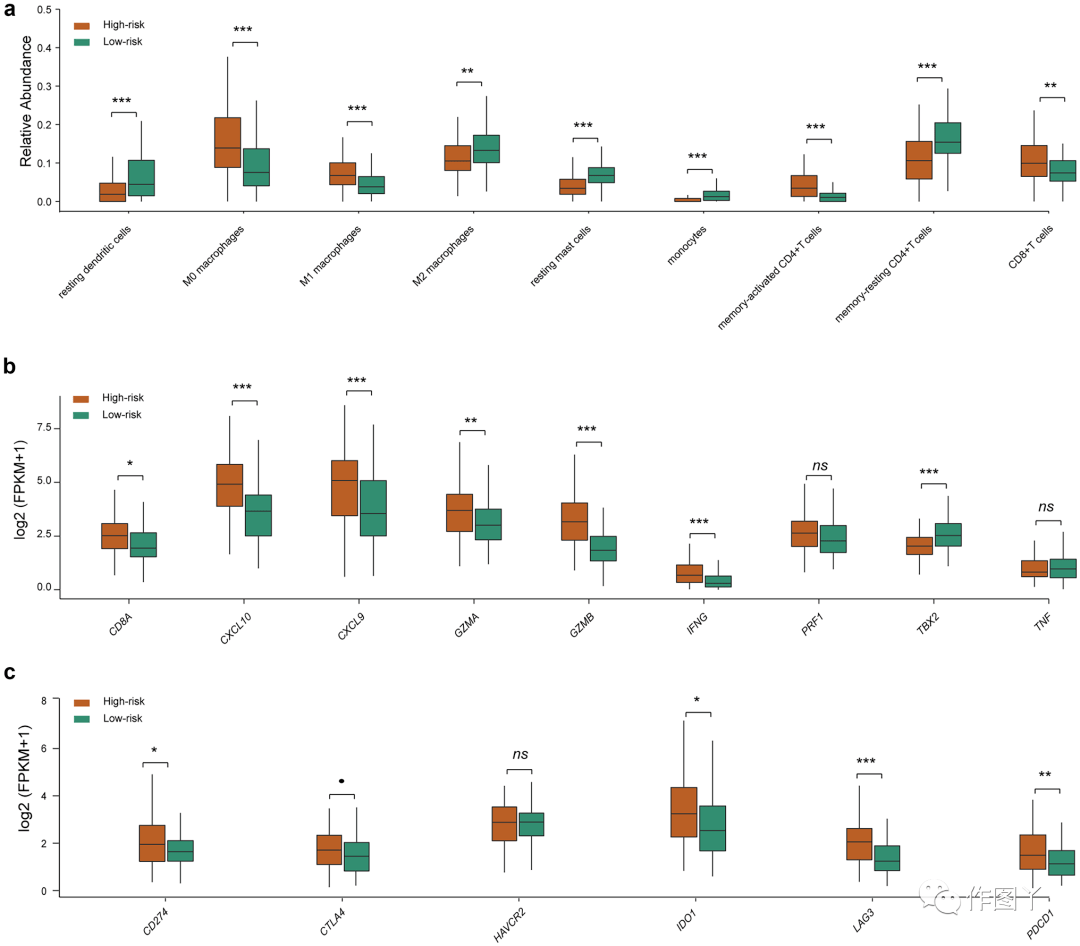
图 4
最后,本研究整合了两个使用免疫检查点抑制剂治疗的高级样本的数据集(测试3)来验证推断。不出意料,接受免疫治疗后,57-MPS鉴定的高危患者2年无进展生存率为45.60%,明显高于低危患者(9.06%)(图5a),提示高危患者可能从免疫治疗中获益更多。多变量 Cox 分析显示,在调整 TMB 和临床因素和 PD-L1后,57-MPS 与 PFS 独立相关(图 5b)。因此,本研究在测试3中生成了包含57-MPS和PD-L1的突变nomogram图(图5c)。1年和2年的nomogram校准曲线显示,突变nomogram的估计与试验3的临床结果之间具有良好的一致性(图5d)。决策曲线分析显示,突变nomogram在测试3的大多数合理阈值概率范围内优于PD-L1(图5e),表明57-MPS可以为接受免疫治疗的LUAD患者的个性化预测估计提供增量价值。
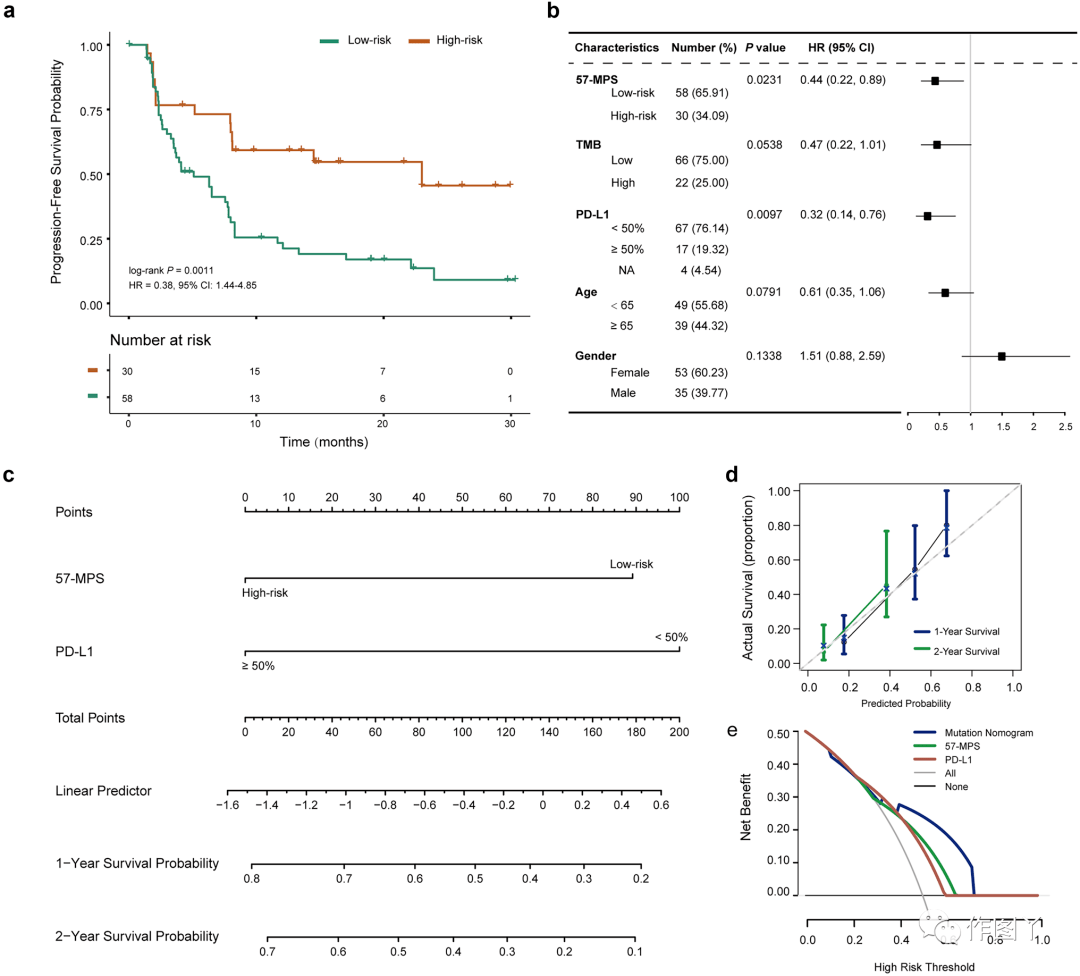
图 5
小编总结
本研究使用癌症基因组图谱中的 I 期患者,确定了每个基因的克隆/亚克隆事件,并根据已发表的稳健的转录组学预后特征预选了一组具有预后特异性突变模式的基因。随后构建了一个突变预后特征 (MPS),其预后性能在 I 期样本的两个数据集中得到了独立验证。预测的高风险患者具有明显更高的免疫细胞浸润,以及更高的细胞毒性和免疫检查点基因表达,并且包含 88 个样本的集成数据集证实高风险患者可以从免疫治疗中受益。开发的 MPS 可以识别 I 期 LUAD 的高危患者,并改善可能受益于免疫治疗的高危患者的个体化治疗计划。
这项研究仍有一些局限性。首先,受限于公开可用的基因组数据,只有两个具有生存信息的回顾性数据集可用于独立验证。尽管构建 57-MPS 的 40-GPS 在多个数据集上都很稳健,但 57-MPS 对 IB 期和 IA 期患者的预后表现值得在多中心前瞻性临床试验中进一步验证。其次,本研究观察到即使患者处于 I 期,测试 2 中的中位生存时间也很短;推测这可能是由于最初选择这些患者时存在一些偏差。第三,这些在测试3中接受免疫治疗的患者处于晚期;因此,需要进一步研究 57-MPS 在 I 期患者免疫治疗中的预测效果。
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:guikequan@hmkx.cn)

本文地址:http://www.bx9y.com/hangye/zhishi/2023-05-05/674279.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 上一篇:直销行业仍能发展与崛起的三大因素:趋势、产品、文化
- 下一篇:返回列表
- 5+肺腺癌预后突变特征的鉴定及免疫治疗预测~2023-05-05 11:37:37
- 直销行业仍能发展与崛起的三大因素:趋势、产品、文化2023-05-05 11:37:18
- 服用赛治治疗甲亢的副作用有这些,你一定要了解2023-05-05 11:37:02
- 看病不再难!县域医学影像中心助推基层医院高质量发展2023-05-05 11:36:21
- 儿科 | 开展读书报告会,在阅读中成长和沁润书香2023-05-05 11:36:04
-

 灵活就业人员社保缴费怎么交?2022年灵活就业人员社保缴费多少钱?
灵活就业人员社保缴费怎么交?2022年灵活就业人员社保缴费多少钱?
2022-06-13
-

 2022年五险一金缴费标准最低是多少?五险一金一个月大概交多少钱?
2022年五险一金缴费标准最低是多少?五险一金一个月大概交多少钱?
2022-08-11
-
15个信号暗示你怀孕了
2022-07-04 12:49:27
-
五险一金多少钱?五险一金缴费标准是多少?
2022-07-01 16:03:05
-
2022年社保缴费基数六个档次是什么?每个月扣多少钱
2022-06-30 15:21:11
-
社保个人缴纳多少钱一个月2022?2022年社保个人缴纳比例是多少?
2022-06-23 09:37:45
-
2022年延迟退休新消息 我国延迟退休年龄对照表
2022-06-23 14:22:08


