癌症新药Nirogacestat获FDA优先审评资格,可治硬纤维瘤
- 2023-03-13 16:37:24
- 知识
2月27日,SpringWorksTherapeutics公司宣布,FDA接受其口服特异性γ-分泌酶小分子抑制剂nirogacestat的新药申请(NDA),nirogacestat是一种在研伽马分泌酶生物制药公司,用以治疗硬纤维瘤(desmoidtumors)成人患者。同时,FDA授予此申请优先审评资格,并预计于2023年8月27日前完成审查。
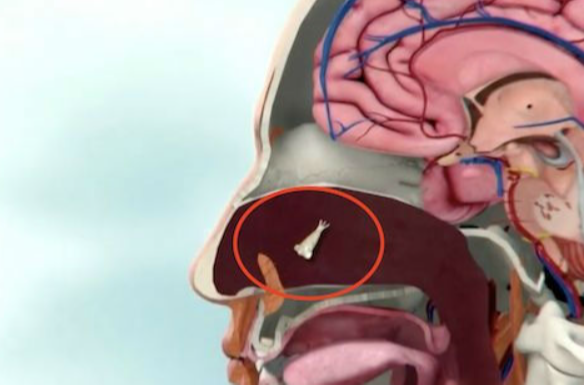
硬纤维瘤是一种罕见的、侵袭性的、局部侵袭性的和潜在病态的软组织肿瘤。尽管硬纤维瘤不会发生转移,但其复发率很高。它可能快速侵袭周围的健康组织,造成严重疼痛、内出血等情况,严重时甚至可能危及生命。硬纤维瘤最常见于20至44岁患者,女性患病率较高。目前,针对该种疾病,还没有获批的疗法。
Nirogacestat是一种口服、选择性、小分子γ分泌酶抑制剂,处于硬纤维瘤的3期临床开发和卵巢颗粒细胞瘤的2期临床开发中。
γ分泌酶可切割多种跨膜蛋白复合物,包括Notch,研究发现Notch在激活有助于硬纤维瘤和卵巢颗粒细胞瘤生长的通路中发挥作用。γ分泌酶也被证明可以直接切割膜结合的B细胞成熟抗原(BCMA),导致细胞表面释放BCMA胞外结构域(ECD)。通过抑制γ分泌酶,可以保留膜结合的BCMA,增加靶点密度,同时降低可溶性BCMAECD的水平,后者可作为BCMA定向疗法的诱饵受体。已在多发性骨髓瘤的临床前模型中观察到Nirogacestat增强BCMA定向疗法活性的能力。
SpringWorks正在评估Nirogacestat作为BCMA增效剂,并与行业领先的BCMA开发人员进行了多次合作,以评估跨模式组合的Nirogacestat。SpringWorks还与FredHutchinson癌症研究中心和Dana-Farber癌症研究所建立了研究合作关系,以使用各种临床前多发性骨髓瘤模型进一步表征Nirogacestat调节BCMA和增强BCMA定向疗法的能力。
Nirogacestat已获得FDA指定用于治疗硬纤维瘤和欧盟委员会指定用于治疗软组织肉瘤的孤儿药。FDA还授予其快速通道和突破性治疗资格,用于治疗患有进行性、不可切除、复发性或难治性硬纤维瘤或深部纤维瘤的患者。
本次NDA的申请主要基于DeFi试验的结果,这是一项随机、双盲、安慰剂对照的3期临床试验,在该项试验中,142名患者随机接受一天两次150mgNirogacestat或安慰剂治疗。关键资格标准包括在筛选前12个月根据实体瘤反应评估标准衡量的肿瘤进展≥20%,主要终点是无进展生存期。试验结果显示,Nirogacestat达到临床试验的主要终点,显著改善患者的无进展生存期,患者疾病进展风险显著降低71%。
Nirogacestat治疗组的确认客观缓解率为41%,安慰剂组为8%,Nirogacestat组的完全缓解率为7%,安慰剂组为0。此外,临床试验达到所有关键次要终点,包括显著改善身体功能和整体与健康相关的生活质量。在安全性方面,Nirogacestat耐受性良好,Nirogacestat最常报告的不良事件包括腹泻、恶心和疲劳,整体安全可控。
针对Nirogacestat获得FDA优先审评资格,SpringWorks首席执行官SaqibIslam表示:“Nirogacestat获得FDA优先审评资格代表了我们为硬纤维瘤患者提供首个获批疗法的雄心壮志的一个重要里程碑。我们期待在审查过程中与FDA密切合作,并继续专注于确保我们有能力在批准后迅速为硬纤维瘤患者提供服务”。

本文地址:http://www.bx9y.com/hangye/zhishi/2023-03-13/658896.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 上一篇:张恩迪委员:建议将中小学生睡眠质量评测纳入管理考核
- 下一篇:返回列表
- 癌症新药Nirogacestat获FDA优先审评资格,可治硬纤维瘤2023-03-13 16:37:24
- 默沙东宣布:K药治疗前列腺癌和非小细胞肺癌研究失败2023-03-13 16:35:02
- 美佛罗里达自来水被污染,男子洗脸后感染食脑虫死亡2023-03-13 16:34:36
- 甲流是不是新冠?详解甲型流感与新冠病毒的区别2023-03-13 16:34:24
- 全国发热门诊就诊人数上升,流感病例成就诊主要群体2023-03-13 16:33:45
-

 灵活就业人员社保缴费怎么交?2022年灵活就业人员社保缴费多少钱?
灵活就业人员社保缴费怎么交?2022年灵活就业人员社保缴费多少钱?
2022-06-13
-

 2022年五险一金缴费标准最低是多少?五险一金一个月大概交多少钱?
2022年五险一金缴费标准最低是多少?五险一金一个月大概交多少钱?
2022-08-11
-
15个信号暗示你怀孕了
2022-07-04 12:49:27
-
五险一金多少钱?五险一金缴费标准是多少?
2022-07-01 16:03:05
-
2022年社保缴费基数六个档次是什么?每个月扣多少钱
2022-06-30 15:21:11
-
社保个人缴纳多少钱一个月2022?2022年社保个人缴纳比例是多少?
2022-06-23 09:37:45
-
2022年延迟退休新消息 我国延迟退休年龄对照表
2022-06-23 14:22:08
文章排行榜
- 周排名
- 月排名